WHO PQ 이어 개별 국가 인허가 확대로 ‘투트랙 전략’ 가속
베트남 민간 수두백신 시장 연평균 32% 성장… 유망 시장 공략 본격화
무항생제 무균공정 ‘MAV/06’ 기반 생백신, 글로벌 경쟁력 입증
GC녹십자(대표 허은철)는 최근 자사의 수두백신 ‘배리셀라주’가 베트남 의약품청(DAV)으로부터 품목 허가를 획득했다고 16일 밝혔다. 이번 승인으로 GC녹십자는 동남아 시장 공략에 본격적인 발판을 마련하게 됐다.
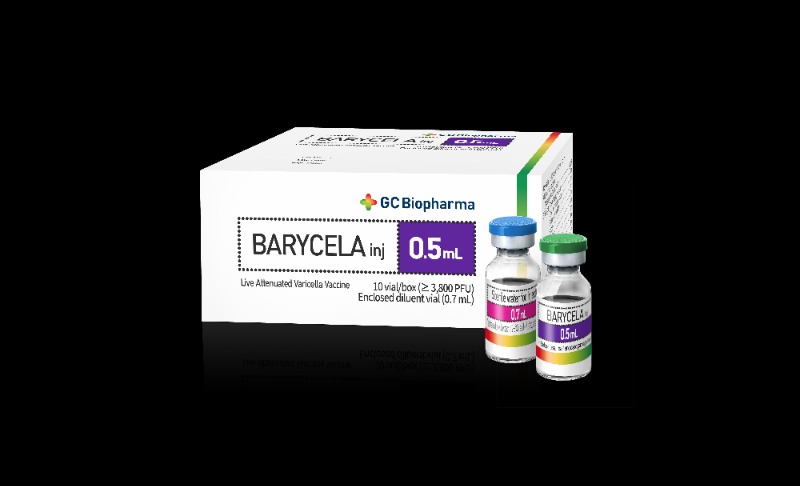
배리셀라주는 2020년 국내 허가를 시작으로, 세계보건기구(WHO)의 사전 적격성 인증(PQ)을 획득한 이후 국제 조달 입찰과 개별 국가 진출을 병행하는 ‘투트랙 전략’을 추진하고 있다. 이번 베트남 진출 역시 그 일환으로, GC녹십자는 현지에서 직접 임상시험을 진행해 제품의 안전성과 면역원성을 입증했다.
베트남 보건부가 최근 규제를 강화하고 있는 가운데, 배리셀라주는 강화된 품질 기준을 충족하며 소아 대상 백신의 안전성과 신뢰도를 확보했다. 특히 항생제를 사용하지 않고 무균 공정으로 생산한 세계 최초의 수두백신이라는 점에서 품질 경쟁력이 더욱 부각된다.
GC녹십자는 베트남의 민간시장 중심 백신 유통 구조에 맞춰, 현지 지사를 통한 직접 판매 전략을 채택했다. 이를 통해 안정적인 연간 고정 매출 창출을 목표로 한다.
베트남의 민간 백신 시장은 2018년부터 2021년까지 연평균 32% 성장했으며, 2021년 기준 약 3억 달러 규모 중 수두백신이 약 10% 비중을 차지하고 있다. 이는 수두백신에 대한 수요가 지속적으로 증가하고 있음을 의미하며, 예방 접종률 역시 꾸준한 상승세를 보이고 있다.
GC녹십자 이재우 개발본부장은 “이번 품목 허가는 단순한 수출 성과를 넘어 현지화 전략이 반영된 결실”이라며 “국제 기준에 부합하는 임상과 품질로 동남아 시장 내 신뢰받는 백신 브랜드로 자리매김하겠다”고 밝혔다.
한편, 배리셀라주는 GC녹십자가 자체 개발한 ‘MAV/06’ 균주를 기반으로 한 생백신으로, 높은 바이러스 함량과 생산 효율성을 갖춘 것이 특징이다. 세계 최초로 무균 공정만으로 생산되며 항생제 없이 제조되는 독자 기술력을 보유하고 있다.
<저작권자 ⓒ 의사나라뉴스, 무단 전재 및 재배포 금지>
서유림 다른기사보기